Part of Thermo Fisher Scientific
Material Safety Data Sheet
Organisms
Organisms this product works with:
For this Organism
Other products used in the isolation of Staphylococcus sp:
CODE : TD0900
Coffret pour la recherche des entérotoxines staphylococciques A, B, C et D par agglutination passive reverse de particules de latex.
COMPOSITION DU COFFRET
Coffret de 20 à 50 tests
TD0901 : Latex anti-entérotoxine A: 5 ml Suspension
de latex sensibilisé par des IgG de lapin anti-entérotoxine
A.
TD0902 : Latex anti-entérotoxine B : 5 ml Suspension de latex sensibilisé par
des IgG de lapin anti-entérotoxine
B.
TD0903 : Latex anti-entérotoxine C : 5 ml Suspension de latex sensibilisé par
des IgG de lapin anti-entérotoxine
C.
TD0904 : Latex anti-entérotoxine D : 5 ml Suspension de latex sensibilisé par
des IgG de lapin anti-entérotoxine
D.
TD0905 : Contrôle latex : 5 ml Suspension de latex recouvert de globulines
de lapin non immunisé.
TD0906 : Entérotoxine staphylococcique A: 5 ml Suspension de latex sensibilisé par
des IgG de lapin anti-entérotoxine
A.
TD0906 : Entérotoxine staphylococcique A: 0,5 ml
TD0907 : Entérotoxine staphylococcique B : 0,5 ml
TD0908 : Entérotoxine staphylococcique C : 0,5 ml
TD0909 : Entérotoxine staphylococcique B : 0,5 ml
TD0907 : Entérotoxine staphylococcique D : 0,5 ml
TD0910 : Diluant :
2 x 50 ml
Tampon PBS contenant 0,5 % (p/v) d’albumine bovine et de l’hexamétaphosphate
de sodium.
PRINCIPE
Des particules de latex sensibilisées par un antisérum de lapin
anti-entérotoxine A, B, C ou D agglutineront en présence de l’entérotoxine
correspondante.
Un réactif contrôle est constitué de particules de latex
recouvertes d’IgG de lapin non immunisé.
Le test est réalisé en plaque de microtitration en V.
Après dilution de l’extrait alimentaire ou du filtrat de culture
dans 5 rangées de puits, les différentes suspensions de latex
sont ajoutées à chaque rangée et le contenu mélangé.
En présence d’entérotoxine, l’agglutination des particules
de latex forme un trouble diffus au fond du puits. Si l’entérotoxine
est présente à un taux plus bas que la limite de détection
ou si elle est absente, un bouton sera observé au fond du puits.
Le diluant contient de l’hexamétaphosphate de sodium qui diminue
l’incidence des réactions non spécifiques dues aux composants
des matrices des aliments.6
MODE D’EMPLOI
A. Préparation de l’échantillon
Aliments
1. Il est souhaitable d’obtenir après extraction un échantillon
limpide et sans graisses. Le procédé d’extraction peut
nécessiter certaines modifications pour des aliments particuliers. La
sensibilité optimale est obtenue avec un facteur de dilution bas, mais
si la nature de l’aliment demande une plus grande dilution lors de l’extraction,
la sensibilité de l’analyse en sera diminuée.
2. Pour obtenir un échantillon représentatif d’un lot,
prélever des échantillons de 10 g à différents
endroits du lot (voir plans d’échantillons T.P.I., U.S.D.A. ou équivalent).
Filtrats de culture
Les staphylocoques provenant de prélèvements cliniques ou d’aliments
doivent être cultivés et identifiés selon les techniques
habituelles.
B. Obtention de la toxine
Extraction à partir d’aliments
1. Mélanger 10 g d’échantillon avec 10 ml d’eau physiologique
dans un broyeur ou un homogénéiseur.
2. Centrifuger 30 minutes à 4°°C à 900 g.
Remarque : si on ne dispose pas de centrifugeuse réfrigérée,
refroidir l’échantillon à 4°C avant de le centrifuger.
3. Filtrer le surnageant sur une membrane de 0,2 µm à faible rétention
pour les protéines. Utiliser le filtrat pour l’analyse.
Production à partir de bouillon de cultures
1. Ensemencer le germe isolé dans du bouillon tryptone soja (CM0129)
et incuber 18 à 24 heures à 37°C de préférence
en agitant.
2. Centrifuger ensuite 20 minutes à 4°°C à 900 g ou filtrer
sur membrane de 0,2 µm à faible rétention pour les protéines.
C. Contrôle
Chaque solution d’entérotoxine est utilisée comme un échantillon
et doit agglutiner la solution de latex correspondante. Ces solutions permettent
de contrôler les réactifs au latex correspondants et constituent
un témoin pour les aspects positifs et négatifs illustrés
au paragraphe : Résultats.
D. Mode opératoire
Suspensions de latex et diluant sont prêts à l’emploi. Bien
mélanger les réactifs au latex avant utilisation pour obtenir
une suspension homogène. Reconstituer chaque flacon d’entérotoxine
avec 0,5 ml de diluant (TD0910). Mélanger doucement jusqu’à dissolution.
1. Chaque échantillon nécessite l’utilisation de 5 rangées
de 8 puits de la plaque de microtitration.
Avec une pipette, répartir 25 µl de diluant dans tous les puits
de chaque rangée.
2. Ajouter 25 µl de l’échantillon dans le premier puits
des 5 rangées et effectuer des dilutions successives dans chaque rangée, à l’exception
du dernier puits de chaque rangée qui ne doit contenir que 25 µl
de diluant.
3. Ajouter ensuite : à la première rangée, 25 µl
de latex antientérotoxine A
à la deuxième rangée, 25 µl de latex antientérotoxine
B
à la troisième rangée, 25 µl de latex antientérotoxine
C
à la quatrième rangée, 25 µl de latex antientérotoxine
D
à la cinquième rangée, 25 µl de contrôle latex
4. Mélanger le contenu de chaque puits par rotation à la main
ou sur un agitateur. Eviter le débordement d’un puits.
5. Recouvrir la plaque d’un couvercle ou la placer dans une chambre humide
et incuber 20-24 heures à température ambiante à l’abri
de toute vibration.
La lecture est facilitée par un papier noir placé sous la plaque
avant l’incubation.
6. Examiner les puits de chaque rangée.
7. Le matériel utilisé doit être ensuite stérilisé à 121°C à l’autoclave
ou désinfecté.
Les bouillons de culture, extraits alimentaires et échantillons sont éliminés
dans une solution d’hypochlorite (> 1,3 % en poids).
E. Lecture et interprétation des résultats
Le degré d’agglutination s’obtient par comparaison avec
les figures ci-dessous.
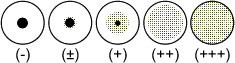
Les résultats classés de + à +++ sont considérés
comme positifs.
Aucune agglutination ne doit apparaître dans la rangée de puits
contenant le contrôle latex.
Quelquefois, une agglutination non spécifique peut apparaître.
Dans de tels cas, la réaction sera considérée comme positive
si l’agglutination avec les particules de latex sensibilisé apparaît à une
dilution plus importante qu’avec le contrôle latex.
Le dernier puits doit être négatif dans toutes les rangées.
Si une agglutination apparaît dans certains de ces puits, considérer
la réaction comme non valable.
Note : certaines souches de staphylocoques sont connues pour produire plus
d’une entérotoxine.
BIBLIOGRAPHIE
1. Shingaki M., et al. (1981) Ann. Rep. Tokyo Metr. Lab. Public Health, 32,
128.
2. Oda T., et al. (1979) Ann. Rep. Fukuoka City Lab. Hyg., 4, 33.
3. Park C. and Szabo R. (1986) Can. J. Microbiol., 32, 723.
4. Oda T. (1978) Jap. J. Bacteriol., 33, 743.
5. Cross B. and Bergdoll M. (1986) J. Clin. Microbiol., 23, 43.
Copyright, Disclaimer and Privacy Policy | Conditions of Sale | About Us | Cookies
Thermo Fisher Scientific Inc.

