Part of Thermo Fisher Scientific
Material Safety Data Sheet
Organisms
Organisms this product works with:
For this Organism
Other products used in the isolation of Staphylococcus sp:
CODE : TD0940
Coffret pour la recherche de la toxine du choc toxique dans les filtrats de culture par agglutination passive reverse de particules de latex.
COMPOSITION DU COFFRET
Coffret de 20 à 50 tests
TD0941 : Latex sensibilisé : 5 ml Suspension de latex sensibilisé par
des IgG de lapin anti-TSST-I.
TD0942 : Contrôle latex : 5 ml Suspension de latex recouverte de globulines
de lapin non immunisé.
TD0943 : Contrôle TST : 0,5 ml Toxine TST desséchée.
TD0944 : Diluant :50 ml
Tampon PBS avec albumine bovine.
PRINCIPE
Todd et coll.1ont été les premiers à décrire le
syndrome de choc toxique. On a indiqué que Staphylococcus aureus, isolé de
patients présentant ce syndrome, produit une toxine responsable de ce
dernier (TSST-I).
Des particules de latex sont sensibilisées par un antisérum purifié de
lapin anti-TSST-I. Elles agglutineront en présence de TSST-I.
Un réactif de contrôle est constitué de particules de latex
sensibilisées par des globulines de lapin non spécifiques.
Le test est réalisé en plaques de microtitration en V.
Des dilutions du filtrat de culture sont effectuées dans 2 rangées
de puits, le réactif au latex est ajouté et le contenu mélangé.
Si TSST-I est présente, une agglutination apparaît formant un
trouble diffus au fond du puits. Si la toxine est présente à une
concentration plus faible que la limite de détection ou si elle est
absente, un bouton sera observé.
MODE D’EMPLOI
A. Préparation de l’échantillon
Staphylococcus aureus peut être testé à partir d’écouvillons,
etc... et identifié selon les procédés habituels.
Si le germe provient de zones telles que le vagin qui sont normalement colonisées
par du staphylocoque, il est recommandé de tester plusieurs colonies
séparément pour détecter plus sûrement une souche
productrice de TSST-I.
B. Obtention de la toxine en bouillon
1. Ensemencer la souche isolée dans un bouillon coeur-cervelle (CM0225).
Incuber 18 à 24 heures à 37°°C de préférence
en agitant .
2. Centrifuger 20 minutes à 900 g à 4°°C et utiliser
le surnageant pour faire le test ou filtrer sur membrane à faible rétention
pour les protéines et utiliser le filtrat.
C. Contrôle
Le contrôle TST doit être utilisé comme un échantillon.
Il agglutinera le latex sensibilisé. Son utilisation permet de vérifier
le réactif au latex et il constitue un témoin pour les aspects
positifs illustrés au paragraphe : Résultats.
D. Mode opératoire
Réactifs au latex et diluant sont prêts à l’emploi.
Agiter vigoureusement les réactifs au latex avant utilisation. Reconstituer
le contrôle TST avec 0,5 ml de diluant (TD0944). Mélanger doucement
jusqu’à dissolution.
1. Chaque échantillon nécessite l’utilisation de 2 rangées
de 8 puits.
2. Répartir 25 µl de diluant dans les puits des 2 rangées, à l’exception
du premier puits de chaque rangée.
3. Ajouter 25 µl d’échantillon aux 2 premiers puits des
2 rangées.
4. Effectuer des doubles dilutions successives dans les 2 rangées du
2ème au 7ème puits. Le dernier puits des 2 rangées ne
contient que du diluant.
5. Ajouter 25 µl de latex sensibilisé à toute la première
rangée.
6. Ajouter 25 µl de contrôle latex à toute la deuxième
rangée.
7. Mélanger par rotation sur un agitateur ou à la main. Eviter
le débordement d’un puits.
8. Recouvrir la plaque d’un couvercle ou la placer dans une chambre humide
et incuber 20-24 heures à température ambiante à l’abri
de toute vibration.
La lecture est facilitée par un papier noir placé sous la plaque
avant l’incubation.
9. Examiner les puits de chaque rangée sur un fond noir.
10.Tout le matériel utilisé doit être stérilisé à 121°C à l’autoclave
ou désinfecté avant élimination.
11.Eliminer le contrôle toxine et les filtrats de culture dans une solution
d’hypochlorite de sodium (> 1,3 % en poids).
E. Lecture et interprétation des résultats
Le degré d’agglutination s’obtient par comparaison avec
les figures ci-dessous.
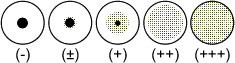
Les résultats classés de + à +++ sont considérés
comme positifs.
La rangée contenant le contrôle latex doit être négative.
Quelquefois, une agglutination non spécifique peut s’observer.
Dans ce cas, considérer la réaction comme positive si l’agglutination
avec le latex sensibilisé est à une dilution plus importante
qu’avec le contrôle latex.
Le dernier puits de chaque rangée doit être négatif. Si
un aspect positif est observé dans certains de ces puits, considérer
la réaction comme non valable.
BIBLIOGRAPHIE
1. Todd J., Fishaut, M., Kapral, F. et Welch, T. (1978) Lancet , ii, 1116.
2. Cohen, M.L. et Falkow, S. (1981) Science, 211, 842.
3. Bergdoll, M.S. et Schievert, P.M. (1984) Lancet, ii, 691.
4. Igarashi, H., Fujikawa, H., Usami, H., Kawabata, S. et Morita, T. (1984)
Infection and Immunity, 44, 175.
Copyright, Disclaimer and Privacy Policy | Conditions of Sale | About Us | Cookies
Thermo Fisher Scientific Inc.

